Membres de l'équipe
Contrôle génétique du développement du cœur
Notre équipe étudie le développement du cœur afin d'identifier les mécanismes biologiques qui sous-tendent l'organogenèse, la régénération et les maladies congénitales.
Apprendre comment les organes se forment dans l’embryon est essentiel pour comprendre les origines des maladies congénitales et pour développer des approches pour réparer les tissus adultes après un dommage. Le cœur est le premier organe à se former et à fonctionner chez l’embryon et le développement cardiaque implique des interactions complexes entre les gènes, les populations de cellules progénitrices et les événements de signalisation intercellulaire. Cette complexité se reflète dans le fait que les malformations cardiaques congénitales touchent 1 naissance sur 100. Notre groupe étudie le développement du cœur chez la souris, où la séquence d’événements développementaux est très similaire à celle de l’homme, en se concentrant sur deux domaines critiques.
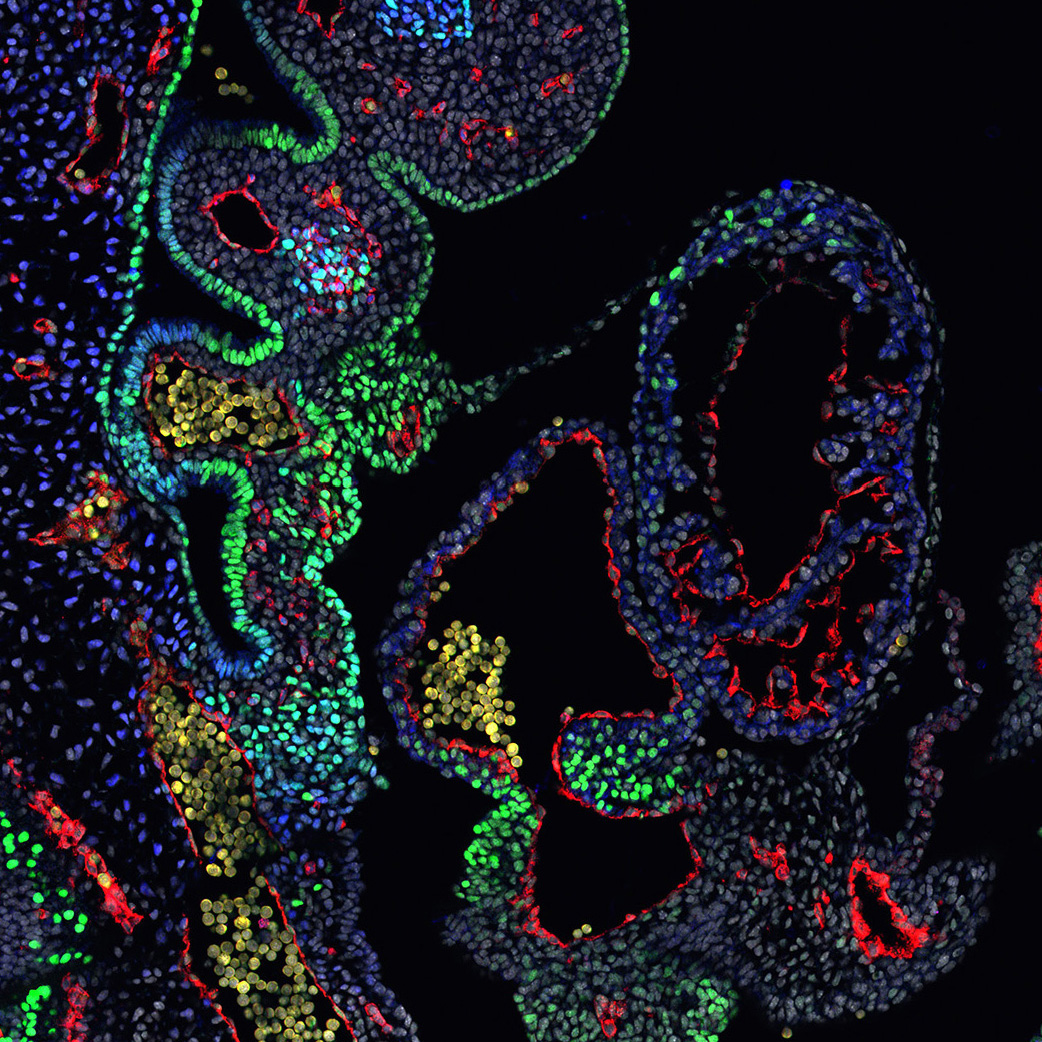
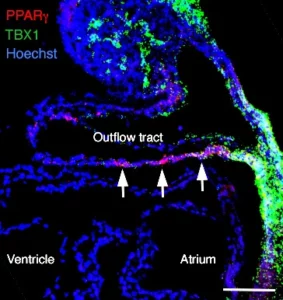
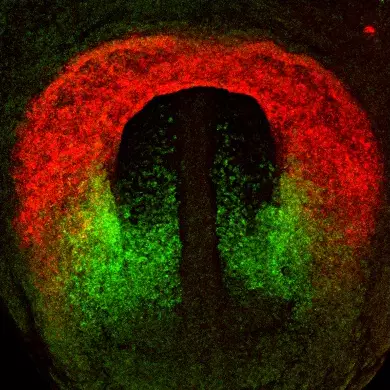
Premièrement, nous étudions la croissance du cœur embryonnaire par l’ajout progressif de myocarde à partir de cellules progénitrices connues sous le nom de deuxième champ cardiaque (SHF). Les parties du cœur dérivées du SHF sont des points chauds pour les défauts cardiaques congénitaux communs. Nous étudions les propriétés des cellules SHF et les mécanismes pilotant leur déploiement dans le cœur. Le programme génétique de la SHF est partagé avec les cellules progénitrices du muscle de la tête, et nous étudions également comment un programme commun diverge pour donner naissance aux muscles du cœur et de la tête.
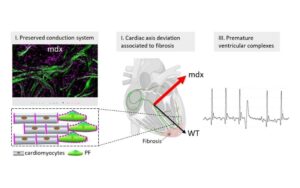
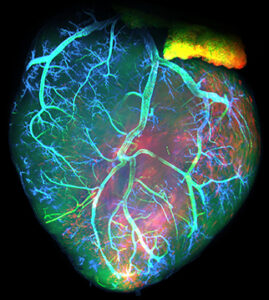
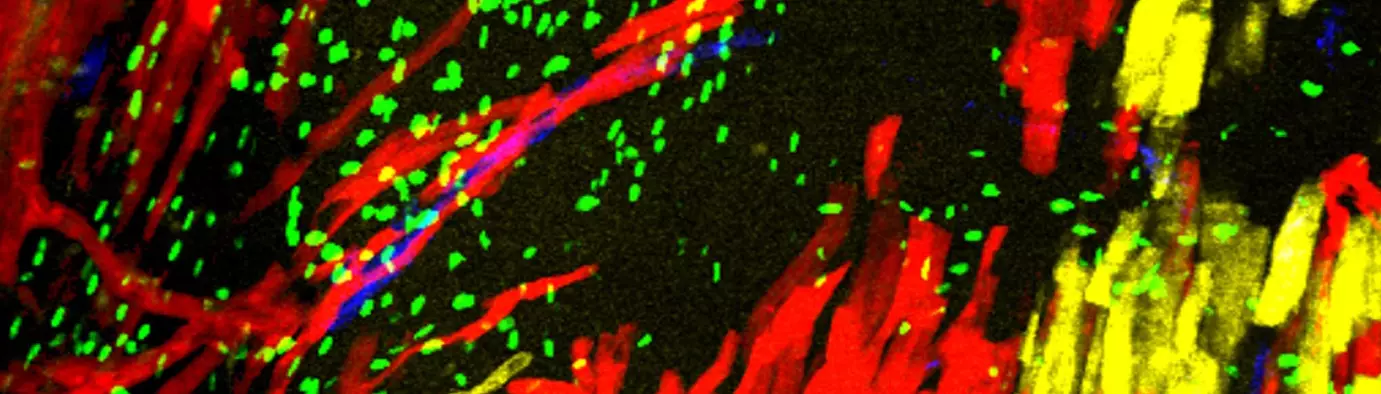
Deuxièmement, nous étudions le développement du système de conduction cardiaque qui forme le câblage électrique du cœur et coordonne les battements cardiaques. Le système de conduction est dérivé de cellules progénitrices communes avec les cardiomyoctyles contractiles du cœur et nous étudions les mécanismes cellulaires et génétiques nécessaires à l’établissement de ces myocytes spécialisés au cours du développement normal et dans des conditions pathologiques.
Publications
Nkx2-5 defines distinct scaffold and recruitment phases during formation of the murine cardiac Purkinje fiber network
Cardiopharyngeal mesoderm origins of musculoskeletal and connective tissues in the mammalian pharynx
Epithelial tension in the second heart field promotes mouse heart tube elongation.
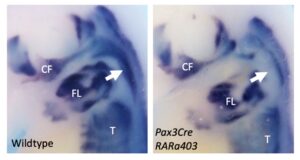
Retinoic acid signalling regulates branchiomeric neck muscle development at the head/trunk interface
Nkx2-5 defines distinct scaffold and recruitment phases during formation of the murine cardiac Purkinje fiber network
Cardiopharyngeal mesoderm origins of musculoskeletal and connective tissues in the mammalian pharynx
Defects in Trabecular Development Contribute to Left Ventricular Noncompaction
Epithelial tension in the second heart field promotes mouse heart tube elongation.
How Mesp1 makes a move
Endothelial Plasticity Drives Arterial Remodeling Within the Endocardium After Myocardial Infarction
Clonal analysis reveals a common origin between nonsomite-derived neck muscles and heart myocardium.
Inducible Cx40-Cre expression in the cardiac conduction system and arterial endothelial cells.
Hes1 expression is reduced in Tbx1 null cells and is required for the development of structures affected in 22q11 deletion syndrome.
Megavoltage planar and cone-beam imaging with low-Z targets: dependence of image quality improvement on beam energy and patient separation.
Integration of embryonic and fetal skeletal myogenic programs at the myosin light chain 1f/3f locus.
Visualization of outflow tract development in the absence of Tbx1 using an FgF10 enhancer trap transgene.
The arterial pole of the mouse heart forms from Fgf10-expressing cells in pharyngeal mesoderm.
Actualités
Une étude remet en question le rôle des fibres de Purkinje dans les arythmies cardiaques de la myopathie de Duchenne.
Le développement du muscle trapèze nécessite une interaction entre le mésoderme pharyngien et le mésoderme somitique chez l’embryon précoce de souris.
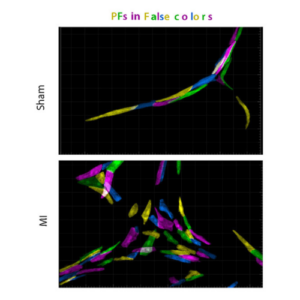
La régénération cardiaque entraîne une hyperplasie du réseau de fibres de Purkinje et des troubles de la conduction ventriculaire.
Pendant la régénération cardiaque, des collatérales se forment pour perfuser la zone infarcie et réparer l’artère coronaire.
Félicitation à Robert Kelly, Frank Schnorrer, Cédric Maurange, Bianca Habermann et Delphine Delacour !
L’équipe Kelly publie dans Nature Com. une étude réalisée par C. Choquet et L. Miquerol sur la mise en place des fibres de Purkinje cardiaques qui servent de cables électriques dans les ventricules pour synchroniser les battements cardiaques.
Cardiopharyngeal mesoderm origins of musculosketelal and connective tissues in the mammalian pharynx
Dans une étude publiée dans Development, Adachi et al ont utilisé le traçage du lignage génétique pour étudier l’origine cellulaire de la gorge chez la souris.
No jobs opportunities found..